Введение
Частым осложнением артериальной гипертензии (АГ) является поражение внутренних органов, т.н. органов-мишеней [1–4]. Состояние функции почек всегда находилось в центре внимания при изучении механизмов развития и течения данного заболевания [5, 6]. Это обусловлено тем, что, с одной стороны, почки играют важную роль в регуляции артериального давления (АД), с другой – сами подвержены поражению при его повышении [7]. Остроту данной проблеме придает факт наличия у больных АГ длительного периода латентно протекающей почечной дисфункции [8]. Данное состояние может длиться десятилетиями, постепенно усугубляясь и перерастая в явную патологию, характеризующуюся клиническими маркерами недостаточности функции почек [9, 10]. Поэтому для клиницистов особенно важным представляется выявления начального периода почечной дисфункции.
Общепризнанным маркером, характеризующим генерализованную дисфункцию сосудистого эндотелия и свидетельствующим о структурно-функциональном нарушении клубочкового аппарата почек, является степень альбуминурии [11]. В то же время почечная дисфункция (ПД), выражающаяся в снижении расчетной скорости клубочковой фильтрации (рСКФ), тесно ассоциируется с высоким риском сердечно-сосудистых событий [12]. Увеличение степени альбуминурии и снижение рСКФ рассматриваются в качестве наиболее ранних признаков поражения почек при АГ [13–15]. Данные показатели считаются независимыми предикторами заболеваемости и смертности от сердечно-сосудистой патологии [16, 17]. В свою очередь данный факт инициировал активное изучение роли нефропротекции для улучшения прогноза при кардиологических заболеваниях [18, 19].
В связи с этим особую актуальность в практике приобретает оценка маркеров, характеризующих нарушения кардиоренальных взаимоотношений. Раннее выявление субклинического поражения почек при АГ и своевременное назначение нефропротективной терапии помогут предотвратить прогрессирование процесса, способствовать его обратному развитию и обеспечить снижение риска осложнений, преждевременной инвалидизации и смертности.
Дополнительный вклад в формирование АГ и связанные с ней сосудистые изменения почек могут вносить существующие особенности этносов, сформировавшиеся в результате исторически сложившихся различий в условиях проживания, питания, ведения традиционных видов трудовой деятельности.
Цель исследования: определить взаимосвязь основных факторов риска сердечно-сосудистых заболеваний с наличием повышенного уровня альбумина мочи и рСКФ у больных АГ среди коренного (шорцев) и некоренного населения Горной Шории.
Материал и методы
Проведено клинико-эпидемиологическое исследование компактно проживающего населения в труднодоступных районах Горной Шории. Сплошным методом обследованы 1186 жителей (721 человек – представители коренной [шорцы], 465 – некоренной национальности). Выборка состояла из взрослого населения, из них 33,8% – мужчины, 66,2% – женщины. Средний возраст мужчин составил 48,0±16,2 года у шорцев и 47,3±18,0 – у некоренных жителей (р=0,695); женщин – 48,5±15,7 и 50,7±15,4 года (р=0,054) соответственно. Из обследованной популяции выделена когорта лиц с АГ, которая в свою очередь подразделялась по этническому признаку на две группы. В первую вошли шорцы в количестве 288 человек, вторую составили некоренные жители – 214 человек. По длительности анамнеза АГ пациенты были распределены на три подгруппы: до 5 лет, 5–10 лет и более 10 лет. По степени АГ обследованные также были разделены на три группы в соответствии с рекомендациями ВНОК 2010 г. Также изучаемые популяции были разделены на три возрастные когорты: младшая (18–44 года), средняя (45–64 года), старшая (65 лет и старше).
Диагноз АГ выставлялся в соответствии с рекомендациями ВНОК (2010). Антропометрическое исследование включило измерение роста, веса, окружности талии (ОТ), расчет индекса Кетле (ИК) [20]. Критерием абдоминального ожирения считалась ОТ более 94 см у мужчин и 80 см у женщин. Содержание общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС-ЛПВП), триглицеридов (ТГ), холестерина липопротеинов низкой плотности (ХС-ЛПНП) в сыворотке крови оценивали с помощью стандартных тест-систем фирмы Thermo Fisher Sientific (Финляндия). Повышение уровня липидов оценивали в соответствии с Европейскими рекомендациями 2012 г. Курившими считали лиц, выкуривавших хотя бы одну сигарету (папиросу) в день.
Анализы крови и мочи производились биохимическим анализатором «КонеЛаб 60I» (Финляндия) на базе МБЛПУ ГКБ № 1 Новокузнецка. Уровень альбумина мочи исследовали фотометрическим методом, его значение более 30 мг/сут принимали за повышенное. Клиренс креатинина рассчитан по формуле Кокрофта–Голта [21], для определения рСКФ полученные значения приводили к средней площади поверхности тела (1,73 м2) [21]. Критерием снижения функции почек считали уровень рСКФ ниже 90 мл/мин/1,73 м2.
Для характеристики признаков рассчитывали среднюю арифметическую величину. Оценка статистической значимости различий качественных показателей проводилась расчетом критериев χ2 Пирсона и Фишера. Значимыми различия признавались при p<0,05. Статистическая обработка проводилась с помощью программы STATISTICA 6.1. Отношение шансов (ОШ) и 95% доверительный интервал (ДИ) вычисляли для определения вероятности развития нарушения функции почек.
Результаты
Частота АГ среди обследованного населения Горной Шории составила 42,3%, при этом среди шорцев она была ниже (39,9%) по сравнению с представителями некоренной национальности (46,1%, р=0,035), что обусловлено значимыми различиями распространенности АГ среди мужчин коренного и некоренного этноса: 33,2 и 45,8% (р=0,013). Среди женщин данные показатели не различались и составили 43,5 и 46,2% (р=0,450) соответственно. В структуре АГ обеих этнических групп преобладали лица с АГ 1-й степени. Доля пациентов с этой степенью АГ реже выявлена у шорцев, чем у населения некоренной национальности: 46,3 против 57,4% (р=0,015). Пациенты с АГ 2-й степени составили 32,1 против 28,9% (р=0,452). Лиц с АГ 3-й степени было больше среди представителей коренного этноса (21,6%) по сравнению с лицами некоренной национальности (13,7%) (р=0,025). Гипотензивные препараты получали 29,6% шорцев и 43,3% некоренного населения, из них процент лиц, достигших целевых уровней АД, составил 9,7 и 19,5% соответственно. Распространенность повышенного уровня альбуминурии у пациентов с АГ значимо не различалась в обеих этнических группах и составила 23,4 среди шорцев и 23,7% среди некоренных жителей (р=0,939).
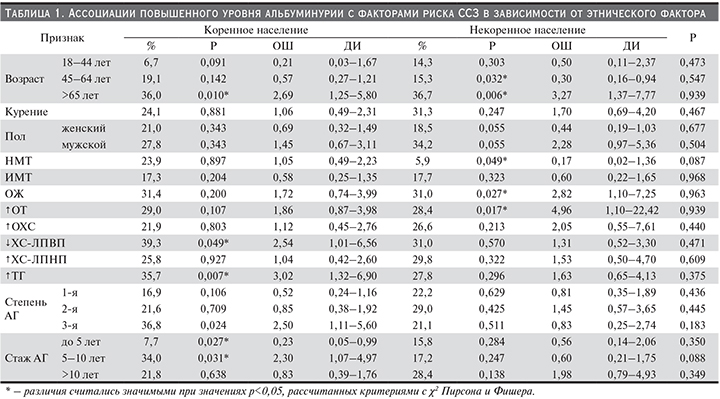
При обследовании когорты шорцев процент лиц с альбуминурией выше 30 мг/сут среди лиц с АГ 1-й степени составил 16,9% [ОШ, 95% ДИ – 0,52 (0,24–1,16), р=0,106], среди лиц с АГ 2-й степени – 21,6% [ОШ, 95% ДИ – 0,85 (0,38–1,92), р=0,709]. Оказалось, что относительный риск выявления повышенного уровня альбуминурии выше в 2,5 раза для лиц с 3-й степенью АГ (36,8%) [ОШ, 95% ДИ – 1,11–5,60, р=0,024] (табл. 1). При обследовании некоренного населения взаимосвязи степени АГ с наличием повышенного уровня альбуминурии не было.
В популяции шорцев также установлена ассоциация между длительностью течения АГ и наличием альбуминурии выше 30 мг/сут: отмечен низкий риск для лиц с продолжительностью АГ до 5 лет (7,7%) [ОШ, 95% ДИ – 0,23 (0,05–0,99), р=0,027] и увеличение риска для лиц с АГ и длительностью анамнеза 5–10 лет (34,0%) в 2,3 раза [ОШ, 95% ДИ – 1,07–4,97, р=0,031]. Среди лиц с продолжительностью АГ более 10 лет данный показатель составил 21,8% [ОШ, 95% ДИ – 0,83 (0,39–1,76), р=0,638]. В группе некоренных жителей взаимосвязи стажа АГ с наличием повышенного значения альбуминурии не было.
Гендерный фактор не оказывал влияния на наличие повышенного уровня альбуминурии в популяции как шорцев, так и некоренного населения. В коренной этнической группе доля мужчин с АГ и альбуминурией выше 30 мг/сут составила 27,8% [ОШ, 95% ДИ – 1,45 (0,67–3,11), р=0,343], доля женщин – 21,0% [ОШ, 95% ДИ – 0,69 (0,32–1,49), р=0,343]. В некоренной этнической группе была выявлена только тенденция к большей доле мужчин (34,2%) [ОШ, 95% ДИ – 2,28 (0,97–5,36), р=0,055] по сравнению с лицами женского пола (18,5%) [ОШ, 95% ДИ – 0,44 (0,19–1,03), р=0,055].
В обеих национальных группах риск выявить пациентов с АГ и повышенным значением альбуминурии в старшей возрастной когорте оказался выше, в т.ч. в 2,7 раза в когорте шорцев (36,0%) [ОШ, 95% ДИ – 1,25–5,80, р=0,010] и в 3,3 раза в когорте некоренного населения (36,7%) [ОШ 95% ДИ – 1,37–7,77, р=0,006]. В коренной этнической группе процент таких лиц в средней возрастной когорте составил 19,1% [ОШ, 95% ДИ – 0,57 (0,27–1,21), р=0,142], в младшей возрастной когорте – 6,7% [ОШ, 95% ДИ – 0,21 (0,03–1,67), р=0,091]. В некоренной этнической группе риск выявления альбуминурии выше 30 мг/сут у обследованных с АГ среди лиц средней возрастной когорты был ниже (15,3%) [ОШ, 95% ДИ – 0,30 (0,16–0,94), р=0,032]; среди лиц младшей возрастной когорты данный показатель составил 14,3% [ОШ, 95% ДИ – 0,50 (0,11–2,37), р=0,303].
В когорте коренного населения процент пациентов с АГ и повышением уровня альбуминурии среди лиц с ИК 18,5–24,9 кг/м2 составил 23,9% [ОШ, 95% ДИ – 1,05 (0,49–2,23), р=0,897]; среди лиц с ИК 25,0–29,9 кг/м2 – 17,3% [ОШ, 95% ДИ – 0,58 (0,25–1,35), р=0,204]; среди лиц с ИК 30,0 кг/м2 и более – 31,4% [ОШ, 95% ДИ – 1,72 (0,74–3,99), р=0,200] соответственно. В когорте некоренного населения отношение шансов выявить пациентов с АГ и повышенным значением альбуминурии среди лиц с нормальной массой тела (5,9%) уменьшалось [ОШ, 95% ДИ – 0,17 (0,02–1,36), р=0,049]. Доля обследованных с АГ и повышенным уровнем альбуминурии среди лиц с избыточной массой тела составила 17,7% [ОШ, 95% ДИ – 0,60 (0,22–1,65), р=0,323], а среди лиц с ожирением риск поражения почек при АГ увеличивался и их доля составила 31,0% [ОШ, 95% ДИ – 2,82 (1,10–7,25), р=0,027].
В популяции шорцев не выявлено взаимосвязи между наличием альбуминурии больше 30 мг/сут и абдоминальным ожирением. В свою очередь в популяции некоренного этноса отношение шансов выявить таких пациентов среди лиц с повышенной ОТ увеличивалось по сравнению с больными, имевшими нормальный показатель ОТ: 28,4 и 7,4% [ОШ, 95% ДИ – 4,96 (1,10–22,42), р=0,017].
В обеих этнических группах взаимосвязи уровня ОХС с повышенным уровнем альбуминурии не выявлено. Среди представителей коренной национальности риск ее выявления среди лиц с повышенным уровнем ТГ и АГ увеличивался по сравнению с обследованными с нормальной величиной изучаемого липидного показателя: 35,7 против 15,5% [ОШ, 95% ДИ – 3,02 (1,32–6,90), р=0,007]. Среди представителей некоренного этноса доля лиц с альбуминурией выше 30 мг/сут среди больных АГ с гипертриглицеридемией (ГТГ) и без нее статистически не различалась. В популяции шорцев среди лиц с низким уровнем ХС-ЛПВП риск поражения почек при АГ увеличивался: повышение уровня альбумина в моче обнаруживалось в 39,3 против 20,3% случаев [ОШ, 95% ДИ – 2,54 (1,01–6,56), р=0,049], и не изменялся в популяции некоренного населения – 31,0 против 25,5% [ОШ, 95% ДИ – 1,31 (0,52–3,30), р=0,570] соответственно. Независимо от национальной принадлежности повышение ХС-ЛПНП не ассоциировалось с наличием альбуминурии выше 30 мг/сут.
У коренных жителей среди курящих пациентов с АГ процент лиц с повышенным содержанием альбумина в моче составил 24,1% по сравнению с некурящими – 23,0% [ОШ, 95% ДИ – 1,06 (0,49–2,31), р=0,881]; у некоренного населения – 31,3 против 21,1% [ОШ, 95% ДИ – 1,70 (0,69–4,20), р=0,247] соответственно.
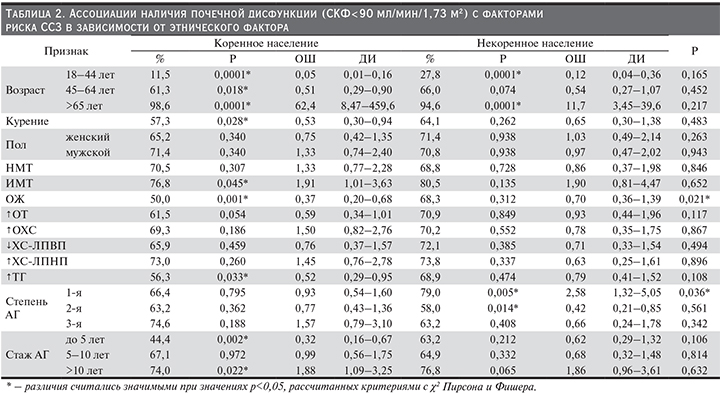
При обследовании коренной этнической группы взаимосвязи между степенью АГ и выявленной ПД не получено. В некоренной этнической группе риск развития ПД (79,0%) выше в 2,6 раза среди пациентов с АГ 1-й степени [ОШ, 95% ДИ – 1,32–5,05, р=0,005] и ниже в когорте больных АГ 2-й степени (58,0%) [ОШ, 95% ДИ – 0,42 (0,21–0,85), р=0,014]. У пациентов с АГ 3-й степени процент лиц с ПД достиг 63,2% [ОШ, 95% ДИ – 0,66 (0,24–1,78), р=0,408] (табл. 2).
Установлено снижение риска возникновения ПД в группе шорцев с длительностью АГ до 5 лет (44,4%) [ОШ, 95% ДИ – 0,32 (0,16–0,67), р=0,002] и, наоборот, увеличение риска данной патологии в 1,9 раза в группе лиц с продолжительностью АГ свыше 10 лет (74,0%) [ОШ, 95% ДИ – 1,09–3,25, р=0,022]. Среди коренных жителей со стажем АГ от 5 до 10 лет доля лиц с ПД составила 67,1% [ОШ, 95% ДИ – 0,99 (0,56–1,75), р=0,972]. В группе некоренных жителей связи между продолжительностью анамнеза АГ и ПД не установлено.
Гендерных различий при нарушении функции почек в обеих этнических группах не было. В когорте шорцев процент мужчин с АГ и ПД составил 71,4 [ОШ, 95% ДИ – 1,33 (0,74–2,40), р=0,340], женщин – 65,2 [ОШ, 95% ДИ – 0,75 (0,42–1,35), р=0,340], в группе представителей некоренного этноса – 70,8 [ОШ, 95% ДИ – 0,97 (0,47–2,02), р=0,938] и 71,4 [ОШ, 95% ДИ – 1,03 (0,49–2,14), р=0,938] соответственно.
В шорской популяции определена связь возраста с наличием нарушения ренальной функции при уровне рСКФ<90 мл/мин/1,73 м2. Отношение шансов выявить ПД ниже у пациентов с АГ младшей (11,5%) и средней (61,3%) возрастных групп [ОШ, 95% ДИ – 0,05 (0,01–0,16), р=0,0001] и [ОШ, 95% ДИ – 0,51 (0,29–0,90), р=0,018] соответственно. В старшей возрастной группе ПД встречалась достоверно чаще (98,6%) [ОШ, 95% ДИ – 8,47–459,56, р=0,0001]. Отношение шансов выявить нарушение функции почек среди лиц младшей возрастной когорты некоренных жителей уменьшалось (27,8%) [ОШ, 95% ДИ –0,12 (0,04–0,36), р=0,0001] и увеличивалось в 11,7 раза среди лиц старшей возрастной когорты (94,6%) [ОШ, 95% ДИ – 3,45–39,6, р=0,0001]. В средней возрастной группе доля лиц с ПД составила 66,0% случаев [ОШ, 95% ДИ – 0,54 (0,27–1,07), р=0,074].
Среди коренного населения частота ПД у лиц с АГ и ожирением была ниже и составила 50,0% по сравнению с представителями некоренного этноса (68,8%), (р=0,021). Отношение шансов выявить ПД в группе шорцев с АГ и избыточной массой тела (76,8%) увеличилось в 1,9 раза [ОШ, 95% ДИ – 1,01–3,63, р=0,045] и уменьшилось в группе лиц с ожирением (50,0%) [ОШ, 95% ДИ – 0,37 (0,20–0,68), р=0,001]. В когорте с нормальной массой тела доля лиц с рСКФ<90 мл/мин/1,73 м2 составила 70,5% [ОШ, 95% ДИ – 1,33 (0,77–2,28), р=0,307]. Среди некоренных жителей с АГ ассоциативных связей между ПД и массой тела не было. В популяции коренных представителей с АГ доля лиц с ПД среди обследованных с нормальной величиной ОТ составила 73,1%, среди шорцев, имевших повышенную ОТ, – 61,5% [ОШ, 95% ДИ – 0,59 (0,59–1,01), р=0,054]; в группе лиц некоренного этноса: 70,9 против 72,3% соответственно[ОШ, 95% ДИ – 0,93 (0,44–1,96), р=0,849].
Уровень ОХС в обеих этнических группах не оказывал влияния на ренальную функцию у лиц с АГ. Представители коренного этноса с АГ подвержены меньшему риску возникновения ПД при ГТГ по сравнению с больными АГ с нормальным уровнем ТГ: 56,3 против 70,9% [ОШ, 95% ДИ – 0,52 (0,29–0,95), р=0,033], в группе некоренных жителей значимых различий не обнаружено – 68,9 против 73,8% [ОШ, 95% ДИ – 0,79 (0,41–1,52), р=0,474]. В обеих этнических группах среди пациентов с АГ снижение ХС-ЛПВП не повлияло на возникновение ренальной дисфункции по сравнению с лицами с его нормальным уровнем. Повышение уровня ХС-ЛПНП не ассоциировалось с наличием ПД в обеих группах с АГ.
При обследовании коренного населения с АГ установлена взаимосвязь между наличием ПД и курением: процент лиц с нарушением ренальной функции среди некурящих лиц был выше и составил 71,7% по сравнению с обследованными, имевшими данную вредную привычку, – 57,3% [ОШ, 95% ДИ – 0,53 (0,30–0,94), р=0,028], в группе некоренного этноса различий не было – 64,1 против 73,3% [ОШ, 95% ДИ – 0,65 (0,30–1,38), р=0,262] соответственно.
Обсуждение
В исследовании ЭССЕ-РФ подтверждена роль АГ и ее степени в развитии поражения почек [22–23]. У нелеченых пациентов из США с АГ распространенность альбуминурии варьируется от 15 до 40% [24]. В крупном популяционном исследовании NHANES III частота повышенной степени альбуминурии у больных АГ составила 16,0% [25]. У жителей Японии в возрасте старше 40 лет повышенный уровень альбуминурии обнаружен в 13,7% случаев [26].
В нашем исследовании доля лиц с повышенным значением альбуминурии составила 23,4% у шорцев и 23,7% у некоренных жителей. Основной причиной ее развития у обследованных жителей Горной Шории можно считать наличие гипертонической нефропатии в отсутствие адекватной гипотензивной терапии, поскольку лица с установленными заболеваниями почек исключались из исследования. Известно, что больные плохо контролируемой АГ имеют более высокий риск прогрессирования почечной дисфункции по сравнению с лицами, которыми достигнуто целевое АД [27]. Согласно данным анкетирования, большая часть обследованных нами пациентов с АГ либо вообще не получали гипотензивную терапию, либо не достигали рекомендованных целевых цифр АД, вследствие чего у многих из них возникло поражение почек.
Среди клинических факторов наиболее значимыми в развитии альбуминурии оказались степень и длительность АГ в коренной этнической группе. Полученные результаты не противоречат данным, согласно которым уровень АД является одним из наиболее важных факторов риска развития альбуминурии [28–29]. Вместе с тем вероятность появления стойкой альбуминурии при АГ существенно возрастает по мере увеличения количества факторов риска сердечно-сосудистых заболеваний (возраст, метаболические изменения, нарушения липидного обмена) [17, 30]. Увеличение частоты альбуминурии с возрастом выявлено в обеих этнических группах и согласуется с литературными данными, которые обосновывают этот факт увеличением стажа АГ и появлением мультифокального атеросклероза магистральных артерий [31–32].
Компоненты метаболического синдрома, по данным эпидемиологических исследований, увеличивают риск развития сосудистого поражения почек [33–36]. Хорошо известна взаимосвязь между альбуминурией с ожирением: так, в исследовании GUBBIO при увеличении ИК на 4 кг/м2 вероятность повышения экскреции альбумина с мочой увеличилась в 1,8 раза у мужчин и в 1,3 – у женщин [37]. Показано нарастание частоты развития альбуминурии при увеличении ИК [38]. Наиболее прогностически неблагоприятным считают абдоминальный вариант ожирения: значение увеличения ОТ подтверждено результатами обследования общей популяции [39–40]. Мы выявили взаимосвязь альбуминурии с ожирением, включая абдоминальное, только для некоренных жителей.
В настоящем исследовании установлена взаимосвязь распространенности повышенного уровня альбуминурии с гипертриглицеридемией и низким уровнем ХС-ЛПВП среди коренного населения. Аналогичные данные выявлены в работе Л.О. Минушкиной (2008): нарушение показателей липидного обмена было чаще среди больных АГ с альбуминурией [41].
Результаты ряда популяционных исследований указывают на существование значимой связи между курением и нарушением функции почек [42–43]. В нашем исследовании установлена взаимосвязь между наличием ПД и курением среди коренного населения: процент лиц с нарушением ренальной функции среди некурящих лиц был выше по сравнению с обследованными, имеющими эту вредную привычку. Данный факт объясняется увеличением числа пациентов с АГ и ПД с возрастом при одновременном уменьшении доли курильщиков в старшей когорте.
Выводы
- Распространенность повышенного уровня альбуминурии среди пациентов с АГ в Горной Шории составила 23,4% у шорцев и 23,7% у некоренных жителей.
- С риском развития альбуминурии выше 30 мг/сут у больных АГ в когорте шорцев ассоциированы степень и длительность течения данного заболевания, возраст, гипертриглицеридемия и снижение ХС-ЛПВП крови, в группе некоренных жителей – возраст и ожирение, в т.ч. абдоминальное.
- Установлена взаимосвязь снижения рСКФ менее 90 мл/мин/1,73 м2 у пациентов с АГ среди коренного населения с длительностью повышения АД, возрастом, наличием избыточной массы тела, ожирения, курения и уровнем триглицеридов крови, среди некоренных представителей – только с возрастом и степенью АГ.

