Выявление хронической болезни почек (ХБП), особенно в декомпенсированные стадии хронической почечной недостаточности (ХПН), не вызывает затруднений. Важно своевременно выявить начальные признаки ХБП и правильно распознать ее при латентном течении. Нередко наблюдается многолетнее бессимптомное течение ХПН, особенно характерное для хронического пиелонефрита, латентного нефрита. С другой стороны, в связи с полиморфизмом поражений внутренних органов при ХПН на первый план могут выходить ее неспецифические «маски»: анемическая, гипертоническая, астеническая, подагрическая, остеодистрофическая. Наличие у больного стойкой нормохромной анемии в сочетании с полиурией и артериальной гипертонией должно настораживать в отношении ХПН [1–3].
На сегодняшний день используются два основных показателя: скорость клубочковой фильтрации (СКФ) < 60 мл/мин/1,73 м2 в течение 3 или более месяцев и соотношение альбуминурия/креатининурия > 30 мг/г в 2 из 3 порций мочи в качестве скринингового теста (CKD classification: NFK KDOQI) [4].
Так, их сравнительная характеристика (т.е. снижение СКФ до 60 мл/мин и максимальной величины относительной плотности мочи менее 1,018) в течение 3 месяцев может говорить о ХПН I степени, при этом креатининемия не должна превышать 350 мкмоль/л [4].
Наиболее достоверным маркером последующих стадий ХПН является концентрация креатинина в крови: при ХПН II степени – 350–650 мкмоль/л, при ХПН III степени – свыше 650 мкмоль/л. Для исключения ошибок в постановке диагноза следует ориентироваться на величины клубочковой фильтрации, которая при ХПН II степени составляет 35–15 мл/мин, при ХПН III степени – ниже 15 мл/мин. Кроме того, определяют уровень мочевины в крови, калия, кальция, фосфора, паратормона, гемоглобина, эритроцитов для оценки функции почек [1, 4].
Но концентрация креатинина в крови не может служить идеальным маркером патологии почек, т.к. уровень креатинина варьируется в зависимости от многих неренальных факторов. Известно, что в организме креатинин образуется из креатина М-метилгуанидинуксусной кислоты, или метилгликоциамина, синтез которого происходит в две стадии с участием трех аминокислот: аргинина, глицина и метионина. В почках из аргинина и глицина образуется гуанидинацетат при действии глицинамидинотрансферазы. Затем гуанидинацетат транспортируется в печень, где происходит реакция его метилирования с образованием креатина. Далее креатин с кровотоком переносится в мышцы, миокард и клетки мозга, где из него под действием креатинфосфокиназы образуется высокоэнергетическое соединение – креатинфосфат. И лишь после этого при участии дефосфорилазы из креатинфосфата образуется креатинин. Так, многостадийный синтез креатинина происходит в разных органах, зависит от их функционального состояния и не может быть эффективным маркером почечной дисфункции [5].
Чаще всего повышение креатинина начинается только после снижения СКФ на 50 % и ниже и при ХПН обычно достигает от 30 до 50 % от расчетного уровня в результате удаления из крови 16–66 % всего креатинина за счет внеклубочковых механизмов: канальцевая секреция и элиминация в кишечнике достигают наибольших величин при снижении СКФ до 15 мл/мин/1,73 м2. Кроме того, уровень креатинина из-за большого функционального резерва почек может оставаться в пределах референтных значений при нарушении функции большей части почечной ткани. Иными словами, креатинин «не видит» ранних стадий снижения СКФ [6, 7]. Таким образом, высокий сывороточный креатинин не специфичен для повреждений почек, а до 50 % ренальных функций могут быть утрачены до повышения уровня креатинина.
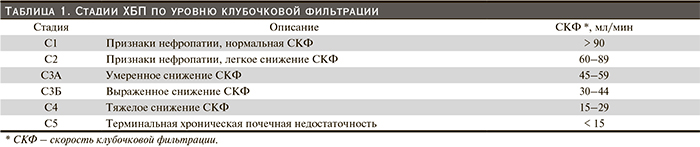
Известен способ расчета СКФ с использованием формулы MDRD (Modification of Diet in Renal Disease) [8]. Соответствие СКФ стадиям ХБП представлено в табл. 1.
Формула MDRD (мл/мин/1,73 м2): СКФ = 186 x (Сr сыворотки, мг/дл)-1,154 x (возраст, годы)-0,203, где Сr – креатинин сыворотки крови; для женщин результат умножают на 0,742; для лиц негроидной расы результат умножают на 1,210.
В настоящее время для детей принята практически единственная формула – Шварца: СКФ = К*L/Cr, где Cr – креатинин сыворотки в мг/дл, L – рост в см, К – коэффициент, равный 0,45 для детей до года, 0,55 – для детей 0–18 лет и 0,7 для юношей с большой мышечной массой [G.J. Schwartz et al. (1987)].
Однако определение СКФ расчетным методом также основывается на определении креатинина в крови и не является, таким образом, идеально точным. Кроме того, в начальную стадию ХБП креатинин не превышает нормальные значения, а значит, даже расчетный метод не является объективным для ранней диагностики ХБП.
Как видно из табл. 1, на первой стадии ХБП регистрируются только признаки нефропатии (анамнестические, ультразвуковые и т.д.), но при этом СКФ остается нормальной. При второй стадии отмечается только легкое снижение СКФ (89–60 мл/мин). Очевидно, что диагностика именно ранних стадий ХБП претерпевает наибольшие трудности. При этом именно на ранних стадиях необходимо назначать адекватную нефропротективную терапию для предупреждения дальнейшего прогрессирования ХБП.
Недостатком указанного способа считается его невысокая достоверность для пациентов с легкой степенью снижения почечной функции. Кроме того, эта формула может занижать значение СКФ у некоторых пациентов, поскольку расчет основан на содержании креатинина в крови [7].
Известны различные способы диагностики начальных стадий ХПН. Например, способ, основанный на проведении велоэргометрии и оценки биохимических показателей сыворотки крови и мочи (см. патент РФ 2070047, МПК A61K35/14, опубл. 10.12.1996). Данный способ характеризуется невысокой точностью диагностики начальных стадий ХПН, обусловленной малой информативностью показателей осморегулирующей функции почек под влиянием велоэргометриии и сложностью ее интерпретации, а 18-часовое ограничение жидкости может приводить к ухудшению функционального состояния почек вследствие сгущения крови.
Известен способ диагностики стадии ХПН, основанный на инструментальном исследовании функционального состояния сердечно-сосудистой системы и измерения массы миокарда левого желудочка (см. патент РФ 2195162, МПК A61B 5/02, A61B 8/00, опубл. 27.12.2002), который имеет невысокую точность диагностики начальных стадий ХПН. Это объясняется тем, что функциональное состояние сердечно-сосудистой системы остается косвенным признаком раннего нарушения работы почек и не может полностью отражать ранние ренальные нарушения.
Достаточно информативным методом являются радионуклидные исследования – динамическая и статическая нефросцинтиграфия. Принцип метода основан на исследовании функционально-структурного состояния почечной паренхимы путем регистрации распределения меченого соединения, медленно выводящегося из почек. Методика исследования заключается в регистрации радиоактивности над областью почек с помощью сканера через 40–60 минут после внутривенного введения тубулотропного препарата 197Hg-npoмерана. Получаемое в процессе исследования на бумаге изображение почек позволяет выявлять зоны повышенного или пониженного накопления меченого препарата. Однако недостатком данной методики являются ее инвазивность, необходимость введения дорогостоящего радиоактивного препарата, наличие гамма-камеры для регистрации исследования [3, 9].
Наиболее близким к заявленному является определение концентрации NGAL (neutrophil gelatinase–associated lipocalin, липокалин, ассоциированный с желатиназой, липокалин-2) в крови [10, 11]. При развитии ренальных заболеваний уровни NGAL в сыворотке постепенно возрастают и коррелируют с тяжестью патологии. Однако этот белок не является высокоспецифичным маркером почечного повреждения, т.к. уровень его может повышаться при стрессовой ситуации и в других органах [12]. Несмотря на то что его уровень повышается при ранней стадии заболевания, нельзя поставить диагноз из-за отсутствия специфичности. Таким образом, метод оказывается невысокоспецифичным, а значит, и недостаточно точным, и появляется необходимость прибегать к более точным и сложным методам.
Задачей настоящего исследования является разработка простого и точного способа ранней диагностики ХБП. Техническим результатом, достигаемым решением поставленной задачи, является диагностирование ранней стадии ХБП.
Поставленная задача решается тем, что после определения NGAL – neutrophil gelatinase–associated lipocalin (липокалина-2) в сыворотке крови определяют концентрацию альбумина и вычисляют коэффициент: NGAL/альбумин и при его значении больше 0,27 диагностируют ХБП.
NGAL экспрессируется и секретируется в кровь различными клетками, находящимися в состоянии стресса, например вследствие воспалительного процесса, а также при ишемии либо при неопластической пролиферации в тканях. При стрессе, связанном с ишемическим поражением почечной паренхимы на ранних стадиях ХБП, NGAL особенно активно синтезируется иммунными клетками и клетками почечных канальцев. Синтез альбумина проходит в печени. Молекулярная масса – около 65 кДа. Нормальный уровень его в крови – 40–60 г/л. В норме отрицательно заряженные молекулы альбумина не фильтруются в клубочках почек и не попадают в мочу. Причиной снижения уровня альбумина могут служить повышенные потери его при патологии почек. Наибольшее падение альбумина плазмы наблюдается при хроническом повреждении клубочков почек, сопровождающемся значительной альбуминурией [5].
Способ может быть осуществлен набором для количественного определения липокалина-2 (NGAL) методом твердофазного иммуноферментного анализа с использованием стандартных 96-луночных иммунологических планшетов «Human Lipocalin-2/NGAL ELISA», Набор для определения липокалина-2/NGAL методом ИФА фирмы «BioVendor Laboratory Medicine, Inc.», Чехия.
Группа контроля состояла из 30 добровольцев в возрасте от 20 до 75 лет без факторов риска ХБП и признаков поражения почек с концентрацией липокалина от 10 до 13 нг/мл, среднее значение – 12,41 нг/мл. Нами впервые получены значения соотношения NGAL/альбумин у здоровых людей. Диапазон колебаний у них составляет 0,22–0,27.
Обследованы 50 пациентов в возрасте от 18 до 76 лет (51,7 ± 13,4) с факторами риска поражения почек (артериальная гипертензия, гиперхолестеринемия, внутрипочечные сосуды). В исследование не включались больные болезнями обмена веществ (сахарный диабет, подагра, амилоидоз), врожденными заболеваниями почек; беременные, а также пациенты с мочекаменной болезнью, гидронефрозом, злокачественными опухолевыми образованиями в почках, имеющие острую почечную недостаточность в анамнезе. При стандартном обследовании у пациентов отсутствовали признаки поражения почек (как клинические, так и биохимические, уровни мочевины, креатинина, альбумина у них соответствовали нормальным значениям). У всех больных мы исследовали уровень NGAL и рассчитали соотношение NGAL/альбумин. У 42 человек выявлено повышение уровня NGAL более 12 нг/мл. Из них 35 пациентов имели соотношение NGAL/альбумин в диапазоне 0,27–0,38. Таким больным мы провели дополнительные методы обследования (статическая нефросцинтиграфия, динамическая нефросцинтиграфия, дуплексное исследование сосудов почек). У больных, которые имели повышенный уровень NGAL, но соотношение NGAL/альбумин менее 0,27, не выявлено признаков поражения почечной паренхимы. А пациенты, у которых отмечено повышение и NGAL, и соотношения NGAL/альбумин, имели единичные очаги поражения почек. Таким образом, мы диагностировали ХБП с помощью предлагаемого нами способа и подтвердили это более инвазивными и дорогостоящими методами. Полученные нами результаты отражены в табл. 2.

Как видно из табл. 2, уровень креатинина и альбумина при начальных стадиях ХБП (С1 и С2) остается в пределах нормальных значений. Концентрация NGAL растет, но причина его роста точно не известна, т.к. он не является специфичным критерием для поражения почек.
Согласно предлагаемому нами способу, если коэффициент NGAL/альбумин превышает 0,27, диагностируют ХБП.
Клинический пример 1. Больной Вадим Р. 56 лет. Клинический диагноз: артериальная гипертензия 2-й ст. ИБС. Состояние больного средней степени тяжести. Самочувствие хорошее, жалоб нет. Клинические признаки почечной патологии отсутствуют. Уровень мочевины крови – 6,1 ммоль/л, креатинин – 82,4 ммоль/л, СКФ расчетным методом – 72,3 мл/мин/1,73 м2. Уровень NGAL – 14 нг/мл, соотношение NGAL/альбумин – 0,35. На основании полученных данных мы диагностировали ХБП-1, что потребовало назначения нефропротективной терапии. Проведенные инструментальные методы диагностики состояния функции почек подтвердили наличие не только факторов риска потери почечных функций, но и единичные мелкие участки поражения почечной паренхимы.
Клинический пример 2. Больная Алия Б. 44 лет. Клинический диагноз: артериальная гипертензия 1-й ст. Гиперхолестеринемия. Состояние удовлетворительное. Самочувствие хорошее. Аппетит сохранен. Уровень мочевины – 4,7 ммоль/л, креатинина – 72,4 ммоль/л. СКФ расчетным методом – 80,1 мл/мин/1,73 м2. Уровень NGAL – 15 нг/мл, соотношение NGAL/альбумин – 0,26. Данные дуплексного сканирования сосудов почек, статической и динамической нефросцинтиграфии подтвердили отсутствие патологии почек.
Как видно из описания и приведенных примеров, предложенный способ позволяет диагностировать поражение почек на ранней стадии, что позволит в максимально ранние сроки назначать нефропротективную терапию нуждающимся в ней пациентам. В свою очередь вовремя начатая и адекватная нефропротекция будет способствовать замедлению прогрессирования ХБП. Предлагаемый нами способ ранней диагностики ХБП, основанный на измерении уровня NGAL, альбумина крови и подсчета соотношения NGAL/альбумин, прост и по точности не уступает инструментальной диагностике.
К его достоинствам относится также следующее: он не требует дополнительного инвазивного вмешательства, использования дорогостоящей аппаратуры и радиофармпрепарата, может быть выполнен в амбулаторных условиях. В отличие от существующих в настоящее время методов способ позволяет более точно диагностировать наличие ХБП, а также не подвергать больных дополнительному забору крови и инвазивным методам диагностики.

